암과 같은 질병은 체내 단백질이 변형을 일으켜 생긴다.
질병을 치료하기 위한 원리와 발병 기작 규명을 위해서는 세포 내 존재하는 수많은
단백질 중 약물과 상호작용하는 특정 단백질을 선택적으로 얻는 과정이 필수적이다.
기존 단백질 정제법은 반응에 첨가되는 다량의 첨가물이 단백질 변성을 일으키거나
얻으려는 단백질 외 다른 단백질까지 추출하여 결과적으로 질병 진단과 치료의 정확도가
떨어지는 한계가 존재했다.
 |
포스텍
김기문 교수(사진)가 단장으로 있는 기초과학연구원(IBS, 원장 김두철) 복잡계 자기조립
연구단은 분자 바구니 쿠커비투릴(Cucurbit[n]urils)*을 이용해 특정 단백질만 고순도,
고효율로 얻을 수 있는 정제법을 개발했다. 기존 단백질 정제법 대비 이종 생물질
오염이 적고 제조, 사용, 보관이 용이하며 저렴하다. 향후 질병 기작 파악, 신약
개발, 약물 부작용 기전 연구에 유용하게 활용될 것으로 기대된다.
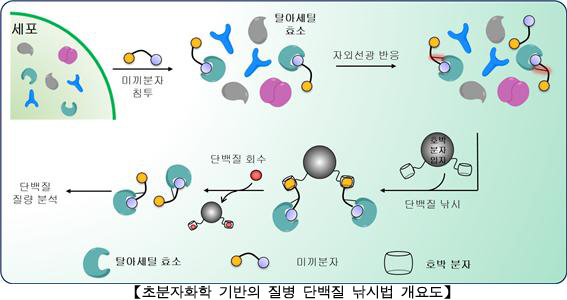
연구진이 활용한 쿠커비투릴은 속이 빈 호박 모양을
한 분자다. 쿠커비투릴은 작은 분자를 담을 수 있는 바구니 역할을 하는데, 화합물인
페로센 등 자기와 꼭 맞는 짝을 찾아 결합하는 특징을 갖고 있다. 연구진은 이러한
쿠커비투릴의 특징을 활용하여 미끼로 유인해 물고기를 잡는 낚시처럼 미끼 물질을
통해 특정 단백질을 얻는 ‘단백질 낚시법’을 새롭게 개발했다.
암의 일종인 피부T세포림프종을 치료하는데 사용되는
사하(SAHA, Suberanilo-hydroxamic acid-ammonium-adamatane) 약물은 탈아세틸화효소*에
선택적으로 상호작용해 병을 치료한다. 하지만, 아직도 이 약물의 작용 기작은 명확히
알려져 있지 않다. 연구진은 변형된 사하(SAHA) 약물을 탈아세틸화효소에 대한 미끼로
사용했다. 사하 미끼가 탈아세틸화효소와 결합하면 낚시 도구인 쿠커비투릴 수용체가
다시 이들과 결합해 탈아세틸화효소를 농축한다. 이후 쿠커비투릴과 보다 강하게
결합하는 페로센 변형 화합물이 미끼인 사하 약물과 치환되면서 탈아세틸화효소만
남아 추출이 가능해지는 것이다. 이로써 초분자화학*을 기반으로 탈아세틸화효소만
선택적으로 분리할 수 있게 되었고, 살아있는 세포 내에서도 모든 과정이 가능함을
증명했다.
 |
|
▶ 먼저 사하 약물을 변형시켜 만든 분자 미끼를 세포에 침투시켜 탈아세틸화효소와 결합시킨 후 자외선을 쬐어 결합을 강화시킨다. 이후 낚시 도구 역할을 하는 쿠커비투릴 수용체를 이들과 결합시킨다. 탈아세틸화효소가 농축되면 사하 미끼를 쿠커비투릴 보다 더 강한 결합력이 있는 페로센과 치환하여 탈아세틸화효소를 분리해 낸다. |
김기문 교수는 "단백질 낚시법으로 사하 외 다른
약물을 분자 미끼로 이용한다면, 암을 비롯한 다양한 질병에 관여하는 단백질을 선택적으로
분리하고 분석할 수 있을 것이다"고 연구의 의의를 밝혔다. 또한 "단백질
낚시법은 기존에 주로 사용하던 정제법과도 상호보완적으로 적용이 가능해 약물의
부작용을 낮추고, 신약 개발 연구에도 유용할 것으로 기대된다"고 말했다.
이번 연구결과는 화학분야의 세계적인 권위지인 안게반테
케미(Angewandte Chemie International Edition, IF 11.709) 2월 1일자 온라인판에
‘주목할 만한 논문(hot paper)’으로 선정, 2월 20일 논문으로 출판됐다.
최혜영 커뮤니케이터
 |
